(一)电池的评价
比能量:电池单位质量或单位体积所能输出电能的多少。
比功率:电池单位质量或单位体积所能输出功率的大小。
质量轻、体积小而输出电能多、功率大、可储存时间长的电池,更适合使用者的需要。
(二)实用电池的特点
(1)能产生比较稳定而且较高电压的电流;
(2)安全、耐用且便于携带,易于维护;
(3)能够适用于各种环境;
(4)便于回收处理,不污染环境或对环境的污染影响较小;
(5)能量转换率高。
(三)几种常见的电池
1、一次电池:放电之后不能充电,内部的氧化还原反应是不可逆的。
干电池:一次电池中电解质溶液制成胶状,不流动。
①碱性锌锰电池
构成:负极是锌,正极是MnO2,电解质是KOH
电极反应为:
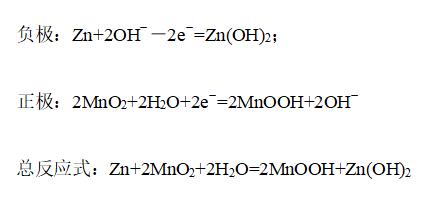
②锌银电池
构成:负极是锌,正极是Ag2O,电解质是KOH
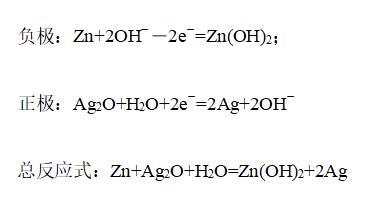
③普通碱性锌锰电池(酸性锌锰电池):
构成:负极是锌,正极是MnO2,电解质是NH4Cl和ZnCl2和淀粉糊
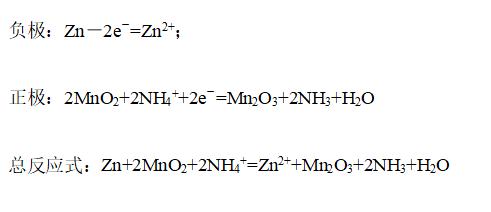
2、二次电池
①铅蓄电池
放电电极反应:
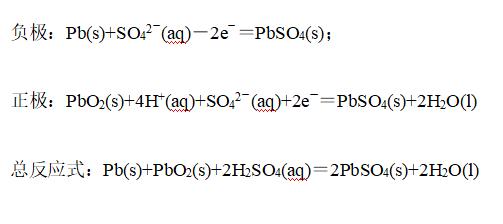
充电电极反应:
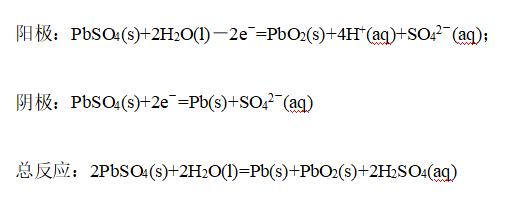
②镍—镉碱性蓄电池
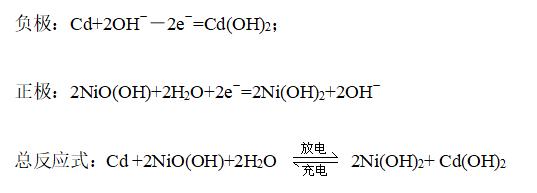
3、燃料电池
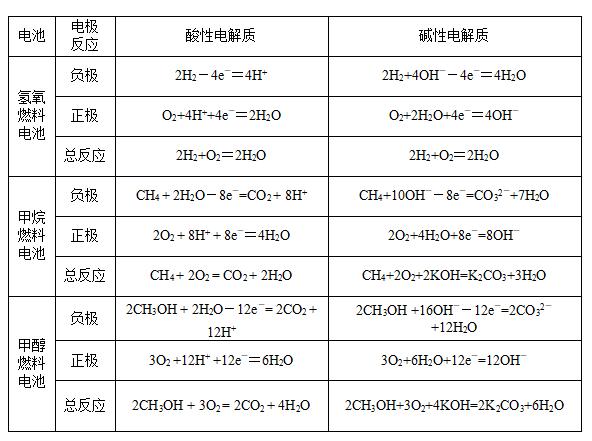
除氢气外,烃、肼、甲醇、氨、煤气等液体或气体,均可作燃料电池的燃料;除纯氧气外,空气中的氧气也可作氧化剂。
燃料电池的能量转化率高于80%,远高于燃烧过程(仅30%左右),有利于节约能源。燃料电池有广阔的发展前途。
(四)正确书写电极反应式
(1)列出正、负电极上的反应物质,在等式的两边分别写出反应物和生成物。
(2)标明电子的得失。
(3)使质量守恒。
电极反应式书写时注意:
①负极反应生成物的阳离子与电解质溶液中的阴离子是否共存。若不共存,则该电解质溶液中的阴离子应该写入负极反应式;
②若正极上的反应物质是O2,且电解质溶液为中性或碱性,则H2O必须写入正极反应式,且生成物为OH-;若电解液为酸性,则H+必须写入反应式中,生成物为H2O。
③电极反应式的书写必须遵循离子方程式的书写要求。
(4)正负极反应式相加得到电池反应的总的化学方程式。若能写出总反应式,可以减去较易写出的电极反应式,从而写出较难书写的电极方程式。注意相加减时电子得失数目要相等。
如对本知识点有疑问,可直接私信作者